This is the translation. The original web-page (oryginalna strona): http://carambola.usc.edu/research/biophysics/BacterialFronts.html
Alison Kraigsley i Paul D. Ronney
Katedra Lotnictwa i Inżynierii Mechanicznej
Uniwersytet Południowej Kalifornii, Los Angeles, Kalifornia 90089-1453
Steven E. Finkel
Katedra Nauk Biologicznych
Uniwersytet Południowej Kalifornii, Los Angeles, Kalifornia 90089-1340
Abstrakt
Chociaż wiele wiadomo na temat samoregenerujących się frontów dyfuzyjnych reakcji, które występują w wielu układach reagujących chemicznie, takich jak płomienie, procesy polimeryzacji i niektóre reakcje wodne, ta ogromna baza wiedzy nie była wcześniej systematycznie stosowana w układach biologicznych, takich jak rozprzestrzenianie ruchliwych bakterii. Celem tej pracy jest (1) ustalenie, czy taką wiedzę można zastosować do systemów biologicznych, oraz (2), jeśli tak, uzyskanie bardziej ilościowego i predykcyjnego zrozumienia systemów biologicznych, które wykazują samoreplikujące się fronty. Analogia między rozprzestrzenianiem się bakterii ruchliwych a innymi samoregenerującymi się frontami będzie badana w odniesieniu do właściwości dynamicznych takich frontów. Początkowe eksperymenty z wykorzystaniem bakterii E. coli rzeczywiście wykazują zachowanie analogiczne do układów dyfuzyjnych reakcji. Staramy się przeprowadzić kompleksowe badanie właściwości dynamicznych, w tym szybkości propagacji, efektów krzywizny przedniej, granic hartowania, granic stabilności, efektów wyporu, efektywnych współczynników dyfuzji i skali czasu reprodukcji. Informacje te zostaną wykorzystane jako dane wejściowe do istniejących modeli analitycznych/numerycznych frontów dyfuzyjnych reakcji i ustalona ważność proponowanych analogii. Ocenione zostaną również różnice między konwencjonalnymi systemami dyfuzyjnymi i mikrobiologicznymi. Jedną z kluczowych różnic jest to, że bakterie ewoluują i reagują na stres, czynnik, który zostanie zbadany poprzez powtórzenie powyższych testów z bakteriami, które przetrwały warunki prawie gaszenia. Dane te zostaną następnie wykorzystane do lepszego zrozumienia przeżywalności i adaptacji bakterii w niesprzyjających warunkach.
Wprowadzenie
Samoprzewodzące fronty reakcji występują w wielu układach chemicznych i fizycznych, w tym w płomieniach, procesach polimeryzacji inicjowanych przez wolne rodniki i niektórych reakcjach wodnych. Wszystkie te układy charakteryzują się dwiema kluczowymi cechami: ośrodkiem reaktywnym (na przykład mieszaniną paliwowo-powietrzną w przypadku płomieni) i autokatalizatorem, który jest produktem reakcji, który również przyspiesza reakcję (na przykład energię cieplną w przypadek płomieni). Autop propagacja ma miejsce, gdy autokatalizator dyfunduje do środowiska reaktywnego, inicjując reakcję i tworząc więcej autokatalizatora. Umożliwia to reakcja-dyfuzja fronty propagować przy stałych cenach daleko od miejsca inicjacji.
Dwa z najważniejszych cech samonamnażających frontach reakcji dyfuzji są szybkość propagacji (s), a granica hartowania. Tempo rozmnażania jest prędkość, z jaką frontowe wkracza reaktywnym środowisku, co zazwyczaj zależy od całkowitej skali czasu reakcji (τ), a współczynnik dyfuzji (D) autocatalyst zgodnie z zależnością s ≈ (D/τ)1/2. t z kolei zależy od stężenia i aktywności reagentów. Granicą hartowania jest minimalna lub maksymalna wartość niektórych parametrów (na przykład minimalne stężenie reagenta lub szerokość kanału), dla których może istnieć stale rozprzestrzeniający się front. Sprzężenie zachodzące między reakcjami chemicznymi a dyfuzyjnym i konwekcyjnym transportem w płomieniach [[1]], fronty polimeryzacji [[2]] i reakcje wodne [[3]] są dobrze znane ilościowo.
Zaskakujące, analogiczna linia dochodzenia nie została zastosowana w systemach mikrobiologicznych, mimo że pierwsze modelowanie frontów reaktywno-dyfuzyjnych prowadzi do relacji s ≈ (D/τ)1/2, przeprowadzono w 1937 r. w kontekście rozprzestrzeniania się chorób zakaźnych (patrz [[4]]). Celem naszego dochodzenia jest ocena wykonalności tego procesu, a następnie opracowanie bardziej ilościowego zrozumienia takich systemów mikrobiologicznych. Większość badań mikrobiologicznych koncentruje się na poszczególnych bakteriach i zliczaniu ich zachowań. W tym badaniu stosujemy prawa termodynamiczne i badamy zagregowane zachowanie dużej liczby osób. Przypadek testowy zdecydujemy się skupić na tym badaniu jest bardzo popularne i szeroko badane Escherichia coli bakterii, ruchliwe bakterie, które (jak wiele innych) pływa wykorzystując swoje macki lub wici w swoich pożywkach natomiast często zmieniając kierunek poszukiwania regiony wyższy stężenie składnika. W szczególności bakteria ma dwa tryby zachowania: tryb „biegowy”, w którym wici obracają się, aby napędzać ją w linii mniej więcej prostej, oraz tryb „bębnowania”, w którym wici powodują zmianę orientacji przy niewielkim ruchu netto [[5]]. Powstały ruch jest nieco analogiczny do losowego chodzenia cząsteczek, co prowadzi do klasycznej dyfuzji Fickia (chociaż mechanizm jest zupełnie inny, ponieważ w przeciwieństwie do cząsteczek ruch bakterii nie jest związany z elastycznymi zderzeniami między bakteriami). Ponadto, przy korzystnym gradiencie składników odżywczych, bakteria działa więcej niż wiruje, co skutkuje wyższym D, podczas gdy w niekorzystnych gradientach wiruje bardziej, pozwalając jej szukać nowych kierunków i skutkując niższym D; prowadzi to również do stronniczego losowego marszu, który sprzyja migracji do regionów o podwyższonym poziomie składników odżywczych.
Te cechy bakterii ruchliwych można wykorzystać do modelowania ich zachowania jako frontów dyfuzji reakcji. Szybkość namnażania (s) E. coli, którą mierzyliśmy (patrz sekcja Wstępne wyniki) w 0,3% pożywce agarowej wynosi około 4,5 mm/godz. Skala czasu reprodukcji (t) E. coli wynosi około 20 minut. Od prędkości propagacji s ≈ (D/τ)1/2, D ≈ s2τ, a zatem D ≈ 1.5 x 10-5 cm2/sek. Wartość ta jest zgodna z oczekiwaną wartością opartą na teorii kinetycznej cząsteczek, która pokazuje, że D jest proporcjonalna do prędkości cząstki (c) pomnożonej przez średnią swobodną ścieżkę cząstki (l), tj. W przypadku cząsteczek odległość cząsteczek poruszaj się, zanim zderzą się ze sobą lub, w przypadku bakterii ruchliwych, zmień kierunek. l można oszacować jako pomnożoną przez czas (t) bakterii pływających bez zmiany kierunku. Dla E. coli zmierzono średnią prędkość pływania 21 µm/sek, z 21 zmianami kierunku w ciągu 30 sekund. To implikuje ≈ 1.4 s i l ≈ 3.0 x 10-3 cm a zatem skuteczna dyfuzyjność D ≈ 6.3 x 10-6 cm2/sek, który jest tego samego rzędu wielkości co wartość D wywnioskowana z D ≈ s2τ.
Dochodzimy do wniosku, że uzasadnione jest scharakteryzowanie rozprzestrzeniania się bakterii ruchliwych jako frontów dyfuzji reakcji. Wiele badań mikrobiologicznych mierzy reakcję układu na gradient temperatury lub składników odżywczych nałożony na układ; zamierzamy pokazać, że bakterie mogą generować własne gradienty, a zatem mogą się rozmnażać. Tabela 1 pokazuje proponowaną analogię między płomieniami (typowy front reakcji-dyfuzji) a układami mikrobiologicznymi.
| Płomień lub właściwości molekularne | Odpowiednik mikrobiologiczny |
| Temperatura | Stężenie bakterii |
| Paliwo | Składniki odżywcze |
| Dyfuzyjność cieplna ≈ cλ | Dyfuzyjność bakterii |
| Dyfuzyjność paliwa | Dyfuzyjność składników odżywczych |
| Prędkość dźwięku (c) | Prędkość pływania bakterii w trybie „biegu” |
| Średnia wolna ścieżka (λ) | c pomnożone przez średni czas przejścia z trybu pracy do trybu bębnowania iz powrotem |
| Skala czasowa reakcji (τ) | Czas reprodukcji |
| Strata ciepła | Śmierć (pojedynczej bakterii) |
| Gaszenie | Śmierć (wszystkich bakterii) |
| Tabela 1. Proponowana analogia między płomieniami a frontami mikrobiologicznymi | |
Czynnikiem komplikującym płomienie oraz ruchliwe bakterie jest fakt, że efektywny współczynnik dyfuzji zmienia się wraz ze stężeniem produktu. W przypadku płomieni produkcja produktów prowadzi do wyższej temperatury, która zwiększa D w prawie wszystkich przypadkach. W przypadku bakterii ruchliwych wiadomo, że bakterie spędzają mniej czasu w trybie „biegania”, a więcej w trybie „bębnowania”, gdy stężenie składników odżywczych jest wysokie (po co się rozglądać, gdy trawa jest już zielona?) oznacza, że średnia wolna ścieżka l będzie niższa, a zatem efektywna dyfuzyjność będzie niższa, gdy stężenie składników odżywczych jest wysokie. W przypadku frontu rozmnożeniowego kilka bakterii na przedniej krawędzi frontu widzi wysokie stężenie składników odżywczych, a zatem ma niskie D. Wyższe stężenia bakterii („produkt” reakcji) na tylnej krawędzi frontu będą występować w pożywka o niższym stężeniu składników odżywczych, a zatem będzie „biec” bardziej i „bębnić” mniej, zwiększając l, a zatem D wzrośnie. Zatem analogia z płomieniami jest dość szeroka.
Wstępne rezultaty
Powyższa dyskusja zachęciła nas do przeprowadzenia wstępnych eksperymentów w celu przetestowania wykonalności naszych propozycji. Te doświadczenia przeprowadzono w 37°C na standardowych płytkach Petriego, stosując pożywkę na bazie wody zawierającą (o ile nie zaznaczono inaczej) 1% NaCl, 1% tryptonu, 0,5% drożdży i 0,1% agaru. Agar zwiększa lepkość podłoża i zasadniczo zapobiega ruchowi luzem. Pożywkę zaszczepiono bakteriami w punkcie (zwykle w środku szalki) i uzyskany postęp (jeśli w ogóle) z przodu bakterii obserwowano wizualnie. Testowano kilka szczepów E. coli. Po początkowym stanie przejściowym wszystkie wykazywały liniowy wzrost promienia przedniego z czasem. Przykład pokazano na ryc. 1.
Rysunek 1 pokazuje, że przód przesuwa się początkowo wolniej, gdy promień przedni jest mały, a przednia krzywizna wysoka. Wszystkie pozostałe testy wykazały ten sam trend. Takie zachowanie obserwuje się na frontach chemicznych, w których produkt autokatalityczny ma niższą dyfuzyjność niż reagent (tj. W przypadku płomieni, wysoką dyfuzyjność cieplną i niską dyfuzyjność paliwa), a przyczyny są dobrze zrozumiałe [[6]]. While the diffusivity of the tryptone nutrient is unknown, by analogy with similar molecules a value of 10-7 cm2/s można oszacować, co jest niższe niż pozorna dyfuzyjność E. coli jak oszacowano powyżej. W konsekwencji zachowanie pokazane na ryc. 1 jest zgodne z modelem dyfuzji reakcyjnej propagacji frontu. Co więcej, teoria płomienia pokazuje, że jeśli stosunek dyfuzyjności produktu do reagenta jest zbyt różny od wartości 1, może to być wyższa lub niższa, mogą wystąpić różne rodzaje niestabilności frontu. Tworzenie wzorów w układach mikrobiologicznych jest dobrze znane [[7]], ale teoria dyfuzji reakcji nie została wykorzystana do kwantyfikacji i przewidywania takich wzorców. Zbadamy takie niestabilności, zmieniając średnią dyfuzyjność poprzez stężenie agaru. Co więcej, podejrzewamy, że ten wybór czasu wirowania E. coli nie jest przypadkowy, ponieważ wpływa na D; jeżeli D jest za niskie lub za wysokie, powstają niestabilności, które mogą być niekorzystne dla przeżycia. Będziemy realizować to pojęcie, badając wpływ stężenia agaru na szybkość i czas wirowania bakterii pod mikroskopem i ustalimy, czy bakteria dostosowuje się (zarówno w locie, jak i przez procesy ewolucyjne) swoją prędkość i czas wirowania zmodyfikować efektywne D, aby utrzymać stabilne fronty.
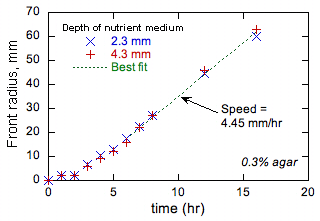
Ryc. 1. Przykładowe dane eksperymentalne dotyczące promieni czołowych bakterii w funkcji czasu.
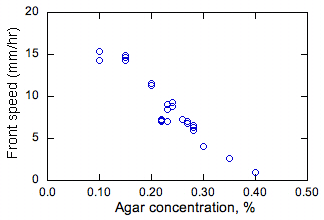
Ryc. 2. Zmierzony wpływ agaru i głębokości roztworu na stałe prędkości propagacji frontów bakteryjnych.
Wpływ stężenia agaru i głębokości pożywki na stałe wartości szybkości namnażania s pokazano na ryc. 2. Przy stężeniu agaru 0,5% lub większym (nie pokazano) podłoże było zasadniczo stałe, a bakterie rozprzestrzeniały się tylko na powierzchni medium, a nie w masie. Zachowanie bakterii podobne do dyfuzji jest w tym przypadku mało prawdopodobne, ponieważ nie potrafią pływać. Przy 0,4% i niższym stężeniu agaru bakterie rozprzestrzeniają się w pożywce. Najwyższe prędkości propagacji (s) zaobserwowano przy najniższych stężeniach agaru (a zatem najniższej lepkości pożywki). Jest to oczekiwane, ponieważ przy niższej lepkości bakteria może pływać szybciej, a zatem powinna mieć wyższą skuteczną D, co prowadzi do wyższych s (ponieważ s jest proporcjonalne do D1/2 jak omówiono powyżej).
Stwierdzono, że głębokość rozwiązania nie ma prawie żadnego wpływu na s. Przyjmując przekroje medium po częściowym rozchodzeniu się frontu, stwierdzono, że fronty są w większości jednakowe w wymiarze pionowym. Zatem przepływ wyporu nie wpływa na te fronty, w przeciwnym razie można by oczekiwać wpływu głębokości rozwiązania na s lub nierównomierności w kierunku pionowym. Ponieważ testy przeprowadzono w powietrzu, obserwacje te wskazują również, że dyfuzja tlenu do podłoża nie jest znacząca, w przeciwnym razie wzrost w pobliżu powierzchni roztworu składników odżywczych byłby inny niż pod powierzchnią. Ten ostatni wynik pokazuje, że bakterie rosną beztlenowo.
Aby ustalić, czy granice „gaszenia” istnieją na frontach bakteryjnych, przeprowadzono eksperyment, w którym fronty bakteryjne próbowały się rozmnażać przez wąskie i szerokie kanały ze ściankami antybiotykowymi. Ponieważ antybiotyki usuwają produkt autokatalityczny (bakterie), działanie ścian jest analogiczne do strat ciepła do zimnych ścian w płomieniach. W przypadku propagacji z przodu w wąskich kanałach dobrze wiadomo, że granica hartowania występuje z powodu strat ciepła do ścianek kanału, gdy liczba Pecleta Pe = sw/D, gdzie w jest szerokością kanału, a D jest dyfuzyjnością, jest mniejsze niż wartość krytyczna. Zatem w obecności strat ciepła fronty mogą rozprzestrzeniać się przez szerokie kanały (wysokie Pe), ale nie wąskie kanały (niskie Pe). Rycina 3 pokazuje, że fronty mogą rozprzestrzeniać się przez kanał szeroki, ale nie przez kanał wąski, co wskazuje na limit hartowania. W niniejszej pracy zostanie przetestowana możliwość zastosowania zależności gaszenia Pe = sW/D = stała na granicy.
Zbadano również wpływ stężenia składników tryptonowych; stwierdzono, że przy połowie wartości nominalnej spread nie wystąpi, podczas gdy s był prawie niezmieniony poprzez podwojenie stężenia tryptonu w stosunku do jego wartości nominalnej. Może to wskazywać na limit wygaszania nawet przy braku ścian antybiotyków. Analogiczne zachowanie występuje w płomieniach z powodu radiacyjnych strat ciepła, gdy stężenie paliwa jest zbyt niskie. Zbadamy ten limit bez ściany i spróbujemy ustalić mechanizm utraty odpowiedzialny za tłumienie propagacji frontu przy niskich poziomach składników odżywczych.
Miareczkowanie pożywki w celu uzyskania liczby bakterii konsekwentnie wykazywało znaczny pik w stężeniu bakterii na czołowym froncie, po którym nastąpił znaczny spadek za frontem, a później w drugim piku daleko za pierwszym. Jest to zgodne z obrazami pokazanymi na ryc. 3. W przyszłych pracach wykorzystamy analizę miareczkowania, aby ustalić, czy grubość frontu ≈ D/s zgodnie z przewidywaniami teoretycznymi. Na podstawie oględzin z ryc. 3 grubość frontu wynosi około 1 mm, co jest bliskie prognozie D/s = (1.5 x 10-3 mm2/sek)/(4.5 mm/godz) = 1.2 mm. Wyniki z dzikim szczepem bakterii wykazały nieco szybszy początkowy stan przejściowy oraz krótszy czas i odległość, aby osiągnąć stały stały współczynnik propagacji w porównaniu do szczepów znakowanych genetycznie.
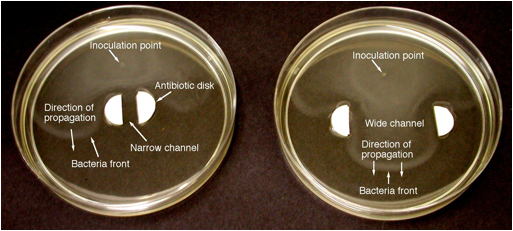
Ryc. 3. Fotografie frontów ruchliwych bakterii E. coli rozmnażających się przez wąskie (6 mm, lewe) i szerokie (35 mm, prawe) kanały z bocznymi ściankami antybiotykowymi Kanamycyny (100 mikrolitrów Kanamycyny na bok), wykonane 6,5 godziny po zaszczepieniu. Oba przypadki: 2086 dzikich szczepów E. coli, 0,1% agar, standardowa pożywka.
Aktualny program badawczy
Opierając się na pozornym sukcesie modelu dyfuzji reakcji w opisywaniu tych wstępnych wyników eksperymentalnych, realizujemy następujący program badawczy:
- Określić wskaźniki rozprzestrzeniania się frontu E. coli w zależności od stężenia składników odżywczych, ruchliwości podłoża (poprzez zmianę stężenia agaru), temperatury otoczenia, stężenia tlenu w otoczeniu (środowisko tlenowe vs. środowisko beztlenowe) oraz grubości warstwy pożywki. Testy te zostaną przeprowadzone w taki sam sposób jak wstępne eksperymenty opisane powyżej. Dodatkowo, aby poprawić wizualizację frontów, zastosujemy barwniki fluorescencyjne specyficzne dla E. coli od Molecular Probes, Inc (Eugene, OR). w celu poprawy wizualizacji frontów. Do wzbudzenia barwników fluorescencyjnych zostanie użyte źródło światła ultrafioletowego (zakupione) lub laser Ar-ion.
- Określ D na podstawie zależności D ≈ s2τ i porównaj z oczekiwanymi na podstawie relacji D = c2τ, gdzie c jest zmierzoną (za pomocą mikroskopu wideo) prędkością (c) i τ średni czas na zmianę kierunku. Standardowe wideo jest wystarczające, ponieważ skala czasu rozruchu wynosi zwykle 1 sekundę, a szybkość klatek wideo wynosi 30 na sekundę.
- Określić granice wygaszania i ograniczyć liczby Pecleta, umożliwiając frontom rozprzestrzenianie się przez kanały o różnej szerokości (w) ze ściankami antybiotykowymi (Kanamycyna lub podobnym) i ustalić, czy Pe jest stały na granicy, tj. Czy szybkość (s) propagacji w granica proporcjonalna do 1/w?
- Określ limit wygaszania przy braku ścian (zmniejszając stężenie składników odżywczych, dla różnych stężeń agaru) i ustal mechanizm utraty (tj. Mechanizm śmierci komórki) odpowiedzialny za ten limit.
- Określić granice stabilności w zależności od stosunku dyfuzyjności produktu (bakterii) do reagenta (substancji odżywczej), zmieniając stężenie agaru w pożywce i stężenie substancji odżywczych. Barwniki fluorescencyjne ułatwią obrazowanie niejednorodnych frontów i tworzenie wzorów.
- Ustal, czy występuje efekt wyporu na propagację z przodu. Ponieważ bakterie E. coli mają gęstość nieco inną niż woda, przy niskiej lepkości wystąpi efekt wyporu. Większość badaczy stosuje agar o wysokiej lepkości, aby zapobiec przepływowi płynu, ale wiele prawdziwych środowisk E. coli ma lepkość podobną do wody. Efekty wyporu zostaną zbadane przez przetestowanie propagacji frontu w podłożu bez agaru w pionowym aparacie z równoległymi płytkami (zwanym komórką „Hele-Shaw” w literaturze z zakresu mechaniki płynów) oraz zaobserwowany zostanie wzór frontu i szybkość propagacji.
- Modeluj te wyniki, korzystając z naszych istniejących analitycznych/numerycznych modeli frontów dyfuzyjno-reakcyjnych.
Oczywiście istnieją również pewne różnice między konwencjonalnymi systemami reakcji-dyfuzji i systemami mikrobiologicznymi. Jedną z kluczowych różnic jest to, że bakterie ewoluują i reagują na stres, czynnik, który zostanie zbadany poprzez powtórzenie powyższego testu z „doświadczonymi” bakteriami, które przetrwały warunki prawie gaszenia. Inną różnicą, jak omówiono powyżej, są tendencyjne właściwości dyfuzyjne. To odchylenie może być modelowane przy użyciu nieliniowej relacji dyfuzji w celu zastąpienia prawa Ficka.
Praktyczne znaczenie
Praca ta jest badaniem dynamiki nowej klasy frontów propagacyjnych z udziałem bakterii ruchliwych. Badanie dynamiki przedniej ma wiele zastosowań, jak omówiono powyżej. Badania te są jednak szczególnie interesujące dla mikrobiologów, ponieważ dotyczą mechanizmów długoterminowego przetrwania i ewolucji wykorzystywanych przez bakterie. Jednym z głównych czynników wpływających na tempo zmian ewolucyjnych w tych układach bakteryjnych są poziomy stresu środowiskowego, a także przejście z jednego środowiska do drugiego. Opracowywane przez nas systemy kultur reprezentują nowe środowiska, w których nie zajęto się tymi kwestiami ewolucji i przetrwania. Niniejsza praca stanowi, według naszej wiedzy, pierwszą próbę biofizycznego scharakteryzowania tych efektów.
Szczególnie interesujące jest badanie wzrostu E. coli w warunkach beztlenowych. Kiedy E. coli (i wszystkie inne bakterie jelitowe) rosną w związku z ludzkim przewodem pokarmowym, rosną w warunkach beztlenowych. Chcemy zacząć badać reakcje na stres bakteryjny przy braku tlenu, aby dalej poszerzać nasze ogólne zrozumienie, w jaki sposób ta bakteria przystosowuje się do życia w różnych niszach środowiskowych. Na przykład obecnie nie wiadomo, czy mechanizmy naprawy i mutacji uszkodzeń DNA, które badał prof. Finkel (i który okazał się ważny dla adaptacji do nowych środowisk), działają w warunkach beztlenowych. Badania te wypełnią lukę między badaniami podstawowymi w obszarach bardziej istotnych z medycznego punktu widzenia.
Referencje
_______________________________________
[1]. Williams, F. A., Combustion Theory, 2nd Ed., Benjamin-Cummins, 1985.
[2]. Pojman, J. A., Hyashenko, V. M., Khan, A. M., “Free-radical frontal polymerization: self-propagating reaction waves.” J. Chem. Soc., Faraday Trans. 92, 2825 (1996).
[3]. Epstein, I. R. Pojman, J. A. An introduction to nonlinear chemical dynamics, Oxford, 1998.
[4]. Winfree, A.T., The Geometry of Biological Time, Springer-Verlag, 1990; Murray, J.D., Mathematical Biology, Springer-Verlag, 1993.
[5]. Berg, H. C., “Motile Behavior of Bacteria” Phys. Today 53, 24 (2000).
[6]. Lewis, B., von Elbe, G., Combustion, Flames, and Explosions of Gases, 3rd ed., Academic Press, 1987.
[7]. Budrene E.O., Berg H. C., “Complex patterns formed by motile cells of E. coli,” Nature 349, 630 (1991).