This is the translation. The original web-page (oryginalna strona): http://www.tulane.edu/~wiser/protozoology/notes/malaria.html
Malaria była i nadal jest przyczyną wielu ludzkich zachorowalności i śmiertelności. Mimo że choroba została zwalczona w strefach najbardziej umiarkowanych, to nadal jest endemiczny przez większość tropikach i strefie podzwrotnikowej.Czterdzieści procent ludności świata żyje na obszarach endemicznych. Epidemie zniszczyły duże populacje i malaria stanowi poważną barierę dla rozwoju gospodarczego w wielu krajach rozwijających się. Istnieje około 300-500 milionów przypadków choroby klinicznej rocznie z 1,5-2,7 mln zgonów. Niektóre z najwcześniejszych znanych pismach medycznych z Chin, Asyrii i Indiach dokładnie opisać malarii jak sporadyczne gorączki. Hipokrates, Ojcze leku, jest zazwyczaj uznawany za pierwszym opisie objawów klinicznych 500 BC ponad 2000 lat przed pasożyta został opisany (tabela). Historia malarii.]
Malaria jest wywoływana przez członków rodzaju Plasmodium. Plasmodium gatunki Apicomplexa (patrz opis ogólny Apicomplexa) i wykazują heteroxenous żywotność udziałem kręgowców oraz wektor stawonogów. Gospodarze kręgowców obejmują: gady, ptaki, gryzonie, małpy i ludzi. Plasmodiumgatunków ogólnie gospodarza specyficznego wektora i specyficzna, każdy gatunek tylko zainfekować ograniczonym zakresie gospodarzy i wektorów. Cztery różne gatunki zakażonych ludzi: P. falciparum, P. vivax, P. ovale i P. malariae. (Patrz strona na różnice gatunku.) Gatunki różnią się w odniesieniu do ich morfologii, szczegóły ich cyklu życia, i ich klinicznych objawów.
Koło życia
Człowieka i innych ssaków Plasmodium gatunki są przenoszone przez komary anopheline. Pasożyt jest wtryskiwany ze śliną w czasie podawania i komarów najpierw ulega rundę merogonia w wątrobie, a następnie przez kilka rund merogonia w erytrocytach. Gametogony zaczyna wewnątrz erytrocytów przyjmującego kręgowców i jest zakończona w ciągu komara gdzie sporogenezy odbywa. Ten cykl życia wykazuje cechy ogólne innych apicomplexan pasożytów charakteryzujących bezpłciowego replikacji i tworzenia inwazyjnych etapach z typowymi wierzchołkowych organelli.
Etap wątroby. Zakażenie następuje, gdy sporozoity wstrzykuje się ze śliną w czasie karmienia komarów. Sporozoity wprowadzić układ krążenia iw ciągu 30-60 minut będzie inwazji komórek wątroby. Host wejście do komórki, tak jak we wszystkich Apicomplexa jest ułatwione przez wierzchołkowych organelli. Po inwazji hepatocytów pasożyt bezpłciowe ulega replikacji. Ten etap replikacji nazywany exoerythrocytic (lub wstępnie erytrocytowy) schizogony. Schizogony odnosi się do replikacji w procesie, w którym pasożyt jest poddawana wielu rundy podziału komórkowego bez podziału cytoplazmatycznej następnie pączkowania lub segmenty, w celu wytworzenia potomstwa. Potomstwo, zwane merozoity uwalniane są do układu krążenia po zerwaniu hepatocytów gospodarza. (Patrz rysunek cyklu życia).
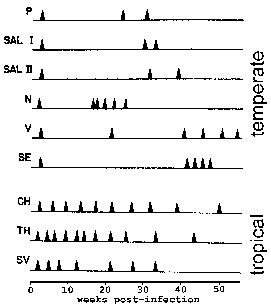
W P. vivax i P. ovale niektórych sporozoitów natychmiast nie ulegają bezpłciową replikacji, ale wchodzi w fazę uśpioną znany jako hypnozoite. (Jednak pewne wątpliwości, czy P. ovale wykazuje etapie hypnozoite zostały podniesione Patrz Richter et al, 2010, Parasitology Badanie 107., 1285), to hypnozoite może aktywować i poddać schizogony w późniejszym czasie, co powoduje nawrót choroby. Nawrót ma szczególne znaczenie w odniesieniu do malarii i odnosi się do reaktywacji zakażenia przez Hipnozoity. Nawrót jest stosowany do opisania sytuacji, w której Parazytemia spada poniżej wykrywalnych poziomów, a potem podnosi się do parazytemii patentowego. Co ciekawe, szczepy wyizolowane z obszarów umiarkowanych zwykle wykazują dłuższy okres utajenia pomiędzy pierwotnym zakażeniu i pierwszym nawrocie niż szczepy z tropikalnego regionów transmisję (rysunek).
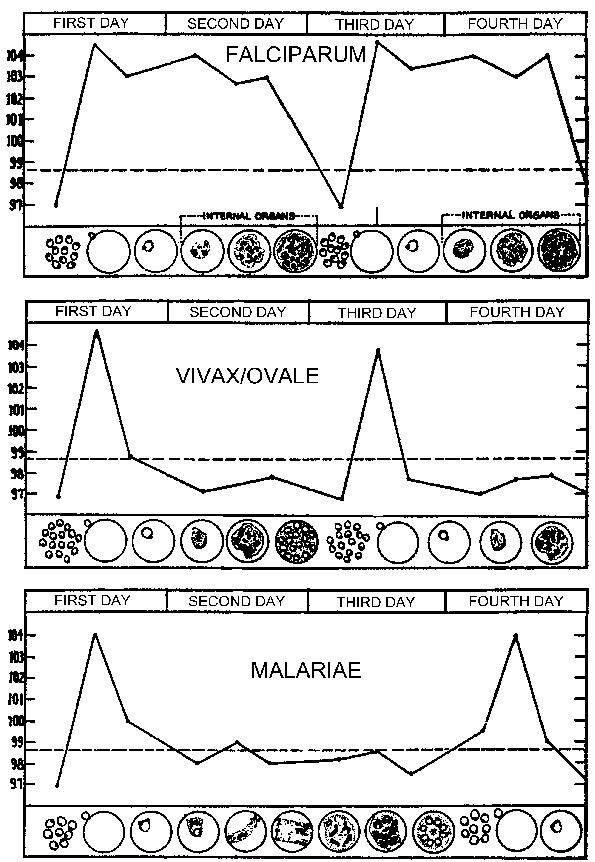
Etap krwi. Merozoitów uwalniane z zainfekowanych komórek wątrobowych inwazji erytrocytów. W merozoity rozpoznawać specyficzne białka na powierzchni erytrocytów i aktywnej inwazji komórek w sposób analogiczny do innych apicomplexan pasożytów. (Patrz szczegóły na temat mechanizmu inwazji komórek gospodarza). Po wprowadzeniu erytrocytów pasożyt ulega okres troficznego następnie przez bezpłciowy replikacji.Młody trophozoite jest często nazywany pierścieniem ze względu na jego morfologii w Giemza-barwionych rozmazów krwi. Wraz ze wzrostem wielkości pasożytów Morfologia „pierścień” znika i jest nazywany trophozoite, W okresie troficznego pasożyt zasysa cytoplazmie komórek gospodarza, a rozkłada się hemoglobinę do aminokwasów. Ubocznym produktem trawienia hemoglobiny pigment malarii lub hemozoin. (Patrz uwagi na wakuoli żywieniowej z Plasmodium). Te złoto-brązowy do czarnego granulek od dawna uznana jako cecha odróżniająca pasożytów we krwi etapach.
Podział jądrowy oznacza koniec etapu trophozoite i początek schizonta etapie. Erytrocytowy schizogongy składa się z rund 3-5 (w zależności od gatunku) replikacji jądrowego następnie kiełkujący procesu. Późne schizonty etap, w którym poszczególne merozoitów stają się dostrzegalne są nazywane segmenters. Te pęknięcia gospodarz erytrocytów i uwalnia się merozoitów. Te merozoitów inwazji nowych erytrocytów i zainicjować kolejną rundę schizogony. Pasożyty we krwi w etapie gospodarza zazwyczaj ulegają synchronicznego schizogony.Jednoczesne pęknięcie zainfekowanych erytrocytów i jednoczesne uwolnienie antygenów i produktów odpadowych kont dla przerywanych napadów gorączki związanych z malarią. Etap krwi w schizogony P. falciparum, różni się od innych ludzkich pasożytów w tym trophozoite- i schizontów zakażonych erytrocytów przylegają do komórek śródbłonka naczyń włosowatych i nie znajdują się w krążeniu obwodowym.Ta sekwestracja jest związany z malarii mózgowej. (Patrz figura cyklu życia).
Scena erotyczna. Jako alternatywa schizogony kilka pasożytów przechodzą cykl płciowy i ostateczne różnicowanie się albo mikro- lub makrogametocyty. Czynniki uczestniczące w indukcji gametocytogenesis nie są znane. Jednakże, zobowiązanie do etapu seksualnym podczas bezpłciowego erytrocytowym cyklu, który bezpośrednio poprzedza formacje gametocyte. Merozoitów córkę przed tym schizontów rozwinie się albo wszystkie bezpłciowych postaci lub wszystkich form seksualnych. Gametocytes nie powodują patologie w przyjmującym ludzką i zniknie z obiegu, jeśli nie podjęte przez komara.
Gametogenezę lub tworzenie mikro- i makrogamety jest indukowany, gdy gametocytes są spożywane przez komara. Po spożyciu przez komara microgametocyte ulega trzy rundy replikacji jądrowego. Te osiem jądra ulegają następnie połączeniu z wici, które wyłaniają się z korpusu microgametocyte. Proces ten jest łatwo zaobserwować w mikroskopie świetlnym ze względu na wici lanie i nazywa exflagellation. W makrogametocyty dojrzeć do makrogamety. Jednak na poziomie morfologicznym jest to znacznie mniej dramatyczny niż exflagellation wystawionej przez mikrogametocyty.
Exflagellation występuje spontanicznie, gdy zakażona krew narażona jest na działanie powietrza. krytycznych czynników zaangażowanych w indukcji tego gametogenezy jest zmniejszenie temperatury, zmniejszenie rozpuszczonego dwutlenku węgla, a następnie wzrost wartości pH powyżej 8,0 (ramka). To nieco naśladuje zmiany środowiskowe doświadczeni przez gametocytes że nastąpi zmiana temperatury otoczenia i jelitach komara wykazuje pH około 7,8 w porównaniu do pH 7,4 do krwi. Ponadto, czynnik exflagellation komary pochodne (MEF) zostały również opisane i określone jako kwas xanthurenic, metabolit z owadami. kwas Xanthurenic obniża permisywnej dla exflagellation pH poniżej 8,0 i ewentualnie sygnalizacji biologiczny pasożyta poddać gametogenezę (Billker i inni, Naturę 392: 289, 1998; Billker i inni, Celi, 117: 503, 2004).
Wysoce mobilny mikrogamety będzie starał się i łączą ze makrogamety. W ciągu 12-24 godzin otrzymaną zygoty rozwija się w ookinete. Ookinete jest ruchomy inwazyjne etap które poprzecznie zarówno peritrophic matrycę i nabłonek jelita środkowego komara. Transversing nabłonek jelita środkowego obejmuje inwazję i wyjście kilku komórek nabłonka przed pojawiające się na podstawowej części nabłonka. Proces inwazja jest podobna do innych Apicomplexa wyjątkiem tego, że ookinete nie posiada rhoptries i nie tworzą wakuoli pasożytniczych po inwazji komórki gospodarza. (Zobacz szczegóły na mechanizmie inwazji komórek gospodarza).
Sporogenezy. Po osiągnięciu pozakomórkowej przestrzeni pomiędzy komórkami nabłonka i blaszki The ookinete rozwija się w oocysty. Oocysty poddane bezpłciową replikacji, zwany sporogenezy, który kulminacją produkcji kilku tysięcy sporozoitami. Zwykle trwa 10-28 dni, zależnie od gatunku i temperatury. Po dojrzewaniu rozrywana oocyst i uwalnia sporozoity, które przecinają blaszki do jamy ciała (hemocoel) komara. (Patrz figura cyklu życia).
Te sporozoity są ruchliwe i mają zdolność do swoistego rozpoznawania ślinianek. Po znalezieniu ślinianki sporozoity zaatakuje i poprzeczna do komórek nabłonka gruczołów ślinowych i leżą w jej prześwitu. Niektóre z tych sporozoitów zostanie wydalony do organizmu kręgowca, ponieważ komary wykonuje posiłku z krwi, a tym samym ponownym zakażeniu u gospodarza będącego kręgowcem. Chociaż sporozoity hemocoel gruczołu ślinowego są morfologicznie podobne, są funkcjonalnie odrębne. Ślinowe sporozoity gruczołów skutecznie atakują komórki wątroby, ale nie może ponownie najechać na gruczoły ślinowe, natomiast sporozoity hemocoel są nieefektywne w inwazji na komórki wątroby.
|
Podsumowując, pasożyt malarii wykazuje cykl życia z typowych apicomplexan funkcji. Istnieją trzy główne etapy: sporozoit inwazyjne, merozoitów i ookinete. Wszystkie charakteryzują wierzchołkowych organelli i może wnikać lub przechodzić przez komórki gospodarza. Obserwuje się dwa różne rodzaje merogonia. Pierwszy, nazwany exoerythrocytic schizogony zachodzi w wątrobie i jest inicjowane przez sporozoitu. Powstałe merozoity następnie inwazji erytrocytów i poddane kolejnym próbom merogonia zwanego erytrocytowy schizogony. Niektóre z wytworzonych z merozoitów erytrocytowym schizogony ulegnie gamogonii. Plasmodium gamogonii opisane jest w dwóch etapach: gametocytogenesis występujące w krwi przyjmującego kręgowców i gametogenezy miejsce w jelicie komara. Fuzji gamet, aby stać się zygoty, który rozwija się w pierwszym ookinete i staje oocystą gdzie sporogenezy następuje.
(Przegląd w cyklu życia komara zobaczyć LA Baton LC Ranford-Cartwright (2005) szerzeniu Nasiona milion zamordowanie śmierć. Metamorfozy malarii w komara Trendy w Parazytologii 21, 573-580.
Objawy kliniczne
Patologii i Objawy kliniczne związane z malarią prawie wyłącznie z bezpłciowe stadium erytrocytowe pasożytów. Schizonty tkanek i gametocytes powodować niewiele, jeśli w ogóle, patologię. Plasmodium infekcja wywołuje ostrą gorączką chorobę, która jest najbardziej widoczna w okresowych napadów gorączka występujących w jednej 48 lub 72 godzinnych przedziałach czasu. Nasilenie ataku zależy od Plasmodium gatunków, a także innych okoliczności, takich jak stan odporności i ogólnego stanu zdrowia i stanu odżywienia zakażonego osobnika. Malaria jest chorobą przewlekłą, która ma tendencję do nawrotu lub nawraca (patrz wyjaśnienie różnicy) w ciągu miesięcy lub nawet lat.
Najczęstszym sposobem uzyskania malarii jest przez naturalne transmisji przez komary (patrz cykl życiowy). Malaria może być również przesyłane poprzez transfuzję krwi lub udostępniania strzykawek. Przekładnia mechaniczna z zakażoną krwią spowoduje krótszy okres inkubacji ponieważ nie będzie etap wątroby. Istnieje również zwiększone ryzyko śmiertelności z mechanicznie transmitowane P. falciparum. Brak zakażenia wątroby etapie wyklucza również nawrotów w P. vivax i P. ovale infekcji. Wrodzony transmisji również udokumentowano, ale uważa się, że pomimo stosunkowo rzadkie ciężkie zakażenia łożyska.
| Exoerythrocytic schizogony a okresy prepatentny i inkubacji | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
Objawy malarii zwykle pojawiają się 10-15 dni po ukąszeniu zakażonego komara. Typowe okresy prepatentny i inkubacji według sporozoitów inokulacji zmieniać się w zależności od gatunku (tabela). Okres prepatentny jest zdefiniowany jako czas od posiewu sporozoitów i wyglądu pasożytów we krwi i oznacza czas trwania etapu wątroby i liczbę merozoitów produkowane. Okresy inkubacji wydają się być nieco dłuższy, które określa się jako czas od posiewu sporozoitów i wystąpieniem objawów. Czasami okresy inkubacji może być przedłużony przez kilka miesięcy w P. vivax, P. ovale, i P. malarii, Wszystkie cztery gatunki mogą wykazywać niespecyficzne objawy zwiastujące kilka dni przed pierwszym febril ataku. Te prodromalnych objawy są zazwyczaj określane jako „grypopodobnych” i obejmują: bóle głowy, lekką gorączkę, bóle mięśni, brak łaknienia, nudności i znużenie. Objawy wydają się korelować ze wzrostem ilości pasożytów.
Te objawy objawami zapowiadającymi następuje atak gorączki znanych również jako malarii napadów. Te napady będzie wykazywać periodyczności pism 48 godzin na P. vivax, P. ovalei P. falciparum, i 72-godzinnym okresowości dla P. malariae. Początkowo okresowość tych paroxyms może być nieregularna jak lęgi z merozoitów z różnych schizonty exoerythrocytic zsynchronizować. Jest to szczególnie prawdziwe w P. falciparum, które mogą nie wykazywać odmienne paroksyzmy, ale wykazują ciągłą gorączkę, napady dziennie lub nieregularnych ataków (np. 36-48 godzin okresowości). Pacjenci mogą również wykazywać śledziony, powiększenie wątroby (żółtaczka), lekkie i niedokrwistość hemolityczna w okresie, w którym wystąpiły napady malarii.
| Malarii paroksyzm | ||||||
|---|---|---|---|---|---|---|
|
Napad malarii (patrz tabela) zwykle trwa 4-8 godzin, a rozpoczyna się nagłego wystąpienia dreszcze, w którym pacjent odczuwa intensywne wrażenie zimna pomimo podwyższonej temperaturze. Jest to często określane jako zimnym etapie, charakteryzuje się energicznie zimna. Natychmiast po tym zimnym etapem jest gorący etap. Pacjent czuje intensywne ciepło towarzyszy silny ból głowy. Zmęczenie, zawroty głowy, brak apetytu, bóle mięśni, nudności i będzie często wiąże się z gorącym etapie. Następny okres obfite pocenie będzie wynikał a gorączka zacznie spadać. Pacjent jest wyczerpany, słaby i będzie zwykle zaśnięcia. Po przebudzeniu pacjent zwykle czuje się dobrze, inne niż zmęczony, i nie wykazuje objawów, aż do początku następnego paroksyzmie.

Okresowość tych napadów wynika synchronicznej rozwoju pasożytów malarii w organizmie gospodarza ludzkiego. Innymi słowy, wszystkie pasożyty u gospodarza są w przybliżeniu w tym samym etapie (tj, pierścień, trophozoite, schizonta) jak przejść przez schizogony. Malarii napad odpowiada pęknięcia zakażonych erytrocytów i uwolnienia merozoitów (figura powyżej). 72-godzinnego okresowości P. malariae ze względu na jego mniejszą wzrostu i dojrzewania, podczas etapu schizogony krwi. Badania na P. vivax wykazują korelację między gorączki i Stężenie TNF-a (czynnik martwicy nowotworu-alfa) w surowicy (Fig prawej). Przypuszczalnie antygeny i toksyny uwalniane podczas zakażone pęknięcia erytrocytów i prowadzą do wytworzenia TNF-a i gorączkowych ataków.
Ciężkość i czas trwania napadów objawów zmienia się w zależności od gatunku (patrz tabela poniżej). Na ogół, ciężkość choroby koreluje ze średnią i maksymalną parazytemii wykazywanej przez różne gatunki. P. falciparum jest zdolny do wytwarzania ciężkiej i śmiertelną infekcję, podczas gdy inne gatunki są rzadko śmiertelne. Pacjenci zakażeni P. vivax, zwłaszcza po raz pierwszy, może być bardzo źle. Jednakże, P. vivax rzadko powoduje komplikacje lub wyniki w śmierci. Na Maluszków ciężką malarię udziałem wielu narządów odnotowano także w P. vivax zakażeń (patrz Kochar et al, EID 11 (1), styczeń 2005). Nawrót do aktywacji P. vivax Hipnozoity może nastąpić za kilka lat. P. ovale jest najbardziej łagodny tym, że napady są zwykle łagodne i krótkotrwałe i nawroty choroby występują rzadko więcej niż jeden rok po pierwotnym zakażeniu. P. malariae ogół wytwarza łagodną chorobę, ale początkowe napady mogą być umiarkowane do ciężkiego. Jest to najbardziej przewlekła, choć i recrudescences zostały udokumentowane kilkadziesiąt lat po początkowym zakażeniu.To przewlekły jest czasem związane z powikłaniami nerek, które są prawdopodobnie związane z odkładaniem kompleksów antygen-przeciwciało w kłębuszkach nerkowych. Malarii napady stają się mniej ciężkie i nieregularny okresowości jaka gospodarza rozwija się odporności. Ta odporność. Jednak nie jest to sterylizacji immunitet tym, że zakażenie utrzymuje dłużej niż objawy i osoby mogą wykazywać nawrotów lub recrudescences lub stać się ponownie zainfekowany. Nieleczona wszystkie formy malarii bywają przewlekły.
| Choroba nasilenia i czasu trwania | |||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
|||||||||||||||||||||||||||||||||||||||||||||
| Zwiększona zachorowalność i śmiertelność z malarią falciparum |
|---|
|
W przeciwieństwie do pozostałych trzech gatunków P. falciparum może produkować poważną chorobę ze śmiertelnymi konsekwencjami. To zwiększenie zachorowalności i śmiertelności po części ze względu na wysokie parazytemii związanych z falciparum P. infekcji. Te potencjalnie wysokie parazytemii są częściowo ze względu na dużą liczbę merozoitów wytwarzanych i zdolności P. falciparum do inwazji wszystkie erytrocyty. W przeciwieństwie do tego, P. vivax i P. ovale wolą retikulocytów (tj niedojrzałe erytrocyty), natomiast P. malariae preferuje starzejących się erytrocytów (patrz różnice gatunków). Parazytemia może gwałtownie wzrosnąć ze względu na cytoadherence i sekwestracji P. falciparum . Ta sekwestracja w tkankach minimalizuje usuwanie zainfekowanych erytrocytów przez śledzionę i pozwala na bardziej efektywne inwazji erytrocytów .. Wysoka Parazytemia i wynik sekwestracja w innych powikłań związanych z falciparum malaria, najbardziej zauważalną jest niedokrwistość i malarii mózgowej (omówione w następnej części ). Niedokrwistość jest częściowo ze względu na niszczenie erytrocytach krwi podczas etapu schizogony. Ponadto, nie zakażonych erytrocytów zniszczeniu przy wyższych prędkościach podczas infekcji i jest zmniejszone wytwarzanie erytrocytów.
Patogeneza i ciężką postacią malarii
Patologie związane ze wszystkimi gatunkami malarii jest związany z pęknięciem zakażonych erytrocytów i uwolnienie materiału pasożytniczej metabolitów hemozoin (tj pigment malarii) i resztek komórek. Oprócz napadów omówionych powyżej, odkładanie hemozoin jest od dawna znany jako charakterystyczną cechę malarii. Istnieje zwiększona aktywność układu siateczkowo-śródbłonkowego, a zwłaszcza w wątrobie i śledzionie, a tym samym jego rozszerzenia, jak wynika z makrofagów zainfekowanych przyjmowanych normalnych i erytrocytów i hemozoin. Z wyjątkiem P. falciparum patologią związaną z malarią zwykle łagodny. Kilka poważnych powikłań może być związane z malarią falciparum z malarii mózgowej jest najbardziej godne uwagi i częstą przyczyną śmierci.
|
Malaria mózgowa charakteryzuje się zaburzeniami świadomości (ramka). Objawy prezentujące są silne bóle głowy, a następnie senność, splątanie i ostatecznie śpiączkę. Drgawki są również często związane z malarią mózgową. Te objawy neurologiczne Uważa się, że wynika z sekwestracji zakażonych erytrocytów w drobnych naczyniach mózgowych. Sekwestracja odnosi się do cytoadherence z trophozoite- i schizontów zakażonych erytrocytów do komórek śródbłonka naczyń głębokich łóżek w ważnych narządów, zwłaszcza mózgu, płuc, jelit, serca i łożysko.Ta sekwestracja ma wiele zalet dla pasożyta. Główną zaletą jest uniknięcie śledziony i późniejsza eliminacja zakażonych erytrocytów. Ponadto, niskie napięcie tlenu w tkankach głębokich może zapewnić lepsze warunki metaboliczne.
Cytoadherence wydaje się zachodzić przez wypukłości o dużej gęstości elektronowej na powierzchni zainfekowanej erytrocytów. Te „gałki” są wyrażane podczas trophozoite i schizontów etapach, powstają w wyniku białka pasożyta eksportowane do błony erytrocytów. Wśród ludzkich Plasmodium gatunku, gałki są ograniczone do P. falciparum, a tym samym sugerują, że gałki odgrywać rolę w cytoadherence. Ponadto, istnieje również dobrą korelację między zwierzęciem Plasmodium gatunków, które wykazują ekspresję pokrętła i sekwestracji. Mikroskopia elektronowa pokazuje również, że pokrętła są punkty styku pomiędzy zakażonych erytrocytów i komórki śródbłonka.
Mechanizmy molekularne cytoadherence obejmować interakcje ligand-receptor. Innymi słowy, białka wyrażane na powierzchni zainfekowanej erytrocytów (ligand) zwiąże się z białek, których ekspresja zachodzi na powierzchni komórek śródbłonka (receptora). Pf EMP-1 ( e rythrocyte m embrane P rotein) to białko pasożyta znajdujący zastosowanie jako ligand cytoadherence (ramka). W constrast do zwykle wysoce konserwatywnej natury interakcji receptor-ligand Pf EMP-1 jest członkiem wysoce zmienna (= zmienna) Rodzina genów 40-50 różnych genów. Kilka białek gospodarza, które prawdopodobnie działają jako receptory określone (pole poniżej). Wiele z tych białek gospodarza działają w interakcjach komórka-komórka i biorą udział w adhezji komórek. Liczne badania wykazały, że ekspresja różnych PF EMP-1 genów skorelowane z różnych fenotypów receptora wiążącego. Ta zmienność antygenowa związane z powierzchni narażonych PfEMP-1 pozwala pasożyta aby unikać układu immunologicznego. Jednak funkcja cytoadherence jest zachowany dzięki swojej zdolności do rozpoznawania wielu receptorów (rysunek). Ta zmienność antygenowa może również stanowić dla różnych efektów chorobowych. Na przykład, cząsteczka adhezji międzykomórkowej-1 (ICAM-1) jest zazwyczaj zaangażowana w patologię mózgu.
|
| Możliwe Receptory |
|---|
|
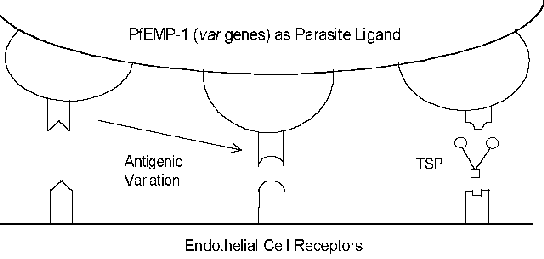
Wczesne obserwacje patologii malarii mózgowej sugeruje związek między dużą liczbą zainfekowanych erytrocytów w mikrokrążeniu i rozwoju zespołu. Początkowo zakładano, że cytoadherence doprowadzi do blokady mechanicznej (tzn niedokrwienie mózgu), a następnie niedotlenienia. Ponadto pasożytem może również powodować lokalne efekty metaboliczne, takie jak hipoglikemia i/lub kwasicy mleczanowej. Efekty niedotlenienie i metaboliczne by następnie spowodować śpiączkę i późniejszej śmierci. Jednak istnieją pewne problemy z hipotezą sekwestracji:
Następstwa neurologiczne wśród ocalałych malarii mózgowej:
van Hansbroek (1997) J. PED. 131: 125 |
- koma związane mózgowe malarii jest szybko odwracalny po zabiegu
- wysoki procent przeżyły nie mają permanant powikłań neurologicznych
- brak uszkodzenia niedokrwiennego (wyklucza niedotlenienie jako głównego mechanizmu)
- sekwestracja występuje również w malaria non-mózgowy.
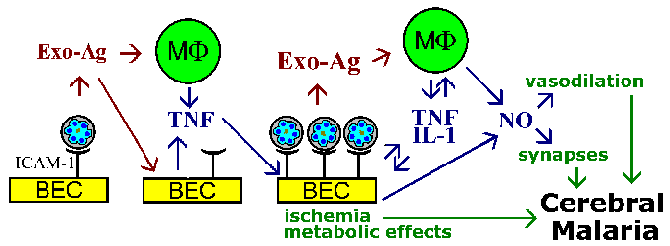
Z powodu tych problemów, inni sugerowali, że śpiączka pośredniczy krótkotrwały cząsteczek, które wpływają na czynność mózgu. Możliwe mediatorów gospodarza obejmują cytokiny, takie jak TNF- a lub tlenek azotu. W tej teorii cytokiny, antygeny malarii, że TNF-a stymulują który może następnie wywołać tlenek azotu, lub inne działania patologiczne. Tlenek azotu jest znana jako mająca wpływ na działanie neuronów i może ponadto prowadzić do nadciśnienia wewnątrzczaszkowego poprzez swoją aktywność rozszerzające naczynia. Jest mało prawdopodobne, chociaż, że układowe uwalnianie cytokin może spowodować śpiączkę i trzeba też postulują, że uwalnianie tych mediatorów w mózgu może doprowadzić do wysokich stężeń lokalnych. Ponadto, istnieje minimalna infiltracji limfocytów lub zapalenie związane z zablokowanych naczyń włosowatych.
Hipoteza sekwestracja i teoria cytokiny dla patofizjologii malarii mózgowej nie wykluczają się wzajemnie, a oba zjawiska mogą być zaangażowane. Na przykład, pasożyty egzo antygeny, które są uwalniane z erytrocytów pęknięcia, są dobrze znane ze stymulacji makrofagów do wydzielania TNF- a. TNF wiadomo że reguluje w górę ekspresję cząsteczek adhezyjnych, takich jak ICAM-1 na powierzchni komórek śródbłonka mózgu. To prowadzi do zmniejszenia wiązania zakażonych erytrocytów i wzmacniać działanie tego, czy są one z powodu zatkania naczyń rozpuszczalnych mediatorów efektami metabolicznymi, lub połączenie (na rysunku).
W podsumowaniu:
- P. falciparum, może spowodować poważne i śmiertelną chorobą
- Ta zwiększona chorobotwórczość w stosunku do innych ludzi malarię jest związane z P. falciparum na:
- wysoka zdolność reprodukcyjna
- cytoadherence i sekwestracja
- Sekwestracja przyczynia się do zwiększenia zdolności reprodukcyjnej poprzez unikanie śledziony
- Cytoadherence do komórek śródbłonka mógł również lokalne efekty patologiczne, aw szczególności jest prawdopodobnie zaangażowane w malarii mózgowej
- Patofizjologia malarii mózgowej nie jest całkowicie zrozumiała, ale prawdopodobnie wiąże się wiele czynników i złożonych oddziaływań pomiędzy gospodarza i pasożyta
Opinie na temat ciężkiej malarii i patogenezy:
- IA Clark, WB Cowden (2003) patofizjologia falciparum malaria. Pharmacology & Therapeutics 99, 221-260 .
- R Idro, NE Jenkins, CRJC Newton (2005) patogenezy, cechy kliniczne i neurologiczne wyniku malarii mózgowej. The Lancet Neurology 4, 827-840 .
- CL Mackintosh, JG Beeson, K Marsh (2004) cechy kliniczne i patogeneza ciężkiej malarii. Trendy w Parazytologii 20, 597-603.
- Trampuz, M Jereb, ja Muzlovic, RM Prabhu (2003) ocena kliniczna: Ciężka malaria. Critical Care 7, 315-323.
Epidemiologia
| Przejdź do sekcji dotyczącej: |
Malaria jest chorobą głównie z tropikalnych i subtropikalnych i jest szeroko rozpowszechniona w gorących regionach wilgotnych Afryki, Azji i Ameryki Południowej i Środkowej. Choroba była również powszechne w wielu obszarach klimatu umiarkowanego w tym USA, Europie i północnej Eurazji i Azji, ale została wyeliminowana. W wielu dziedzinach które wcześniej malarii pod kontrolą przeżywają odrodzenie (patrz artykuł w The Atlantic).Cztery gatunki malarii ludzkie wykazują nakładającą się dystrybucję geograficzną (tabela). P. vivax i P. falciparum są najczęściej występującymi rodzajami z P. vivax są najbardziej rozpowszechnione geograficznie. Mieszane infekcje są powszechne w obszarach endemicznych. Molekularne metody sugerują, że P. malariae i P. ovale mogą być bardziej rozpowszechnione i powszechne, że dotychczas uważano (patrz Mueller i wsp, Tr Parasitol., 23: 278 , 2007).
Podział geograficzny |
||||||||
|---|---|---|---|---|---|---|---|---|
|
| Malaria Epidemiologia |
|---|
Stabilna lub endemicznych malarii
Niestabilny lub epidemia malarii
|
Epidemiologii malarii mogą być oglądane w zakresie, który jest trwały (lub endemicznych) lub niestabilnych (lub epidemii).Stabilne malarii odnosi się do sytuacji, w której nie jest mierzalna występowanie naturalnego transmisji przez wiele lat.Byłoby to także obszary, które doświadczają transmisję sezonowe. Różne obszary mogą wystąpić różne poziomy zachorowalności i to jest często oznaczana przez: hypoendemic, mesoendemic, hiperendemicznej i holoendemic. Osób mieszkających w obszarach endemicznych zwykle wykazują bardzo wysoką odporność i tolerowania zakażenia dobrze.
Niestabilny, albo epidemicznym malaria odnosi się do zwiększenia malarii w obszarach o niskiej endemicznych lub ognisk w obszarach uprzednio nie malarii lub wśród osób nie immunologicznych. Ogniska te mogą być zazwyczaj przypisuje się zmiany w zachowaniu człowieka lub wpływu na środowisko.Na przykład, migracji ludzkich i ponowne zagospodarowanie można albo wprowadzać malarii na obszar lub odsłonić populacji wcześniej niż odpornościową endemicznych transmisji. Zmiany w ekologii spowodowane klęskami żywiołowymi lub robót publicznych projektów, takich jak budowa dróg może również wpłynąć na transmisję malarii i doprowadzić do epidemii.
| „Wszystko na temat malarii jest tak uformowany przez miejscowych warunków, które staje się tysiąc epidemiologiczne zagadek.” Hackett (1937) |
Powyższy cytat podkreśla złożoność malarii i wielu aspektów eksponaty chorobowych. Różne społeczności doświadczy inny malarii, aw konsekwencji różne strategie kontroli i leczenia może być konieczne. Zawiłe interakcje gospodarza pasożyta, i wektory są głównymi czynnikami tej złożoności epidemiologicznych.
Na przykład, jak w przypadku wszystkich chorób wektora przesyłane pasożyt musi być w stanie nawiązać przewlekłego zakażenia w organizmie gospodarza w celu zwiększenia możliwości transmisji. Jest to szczególnie prawdziwe w przypadku transmisji sezonowych oraz w obszarach o niskiej endemiczności. I w ogólnych infekcji malarii cechuje początkowej ostrej fazy, a następnie jest już stosunkowo bezobjawowej fazy przewlekłej. Wynika to częściowo z zdolności pasożytów do uniknięcia całkowite usunięcie przez układ immunologiczny. Na przykład, P. falciparum wykazuje antygenowej zmienności, który pozwala na pobyt o jeden krok przed układem odpornościowym. Ponadto, P. vivax i P. ovale wykazują stopień hypnozoite i są zdolne do rzutów.Pozwala to na utrzymanie pasożyta zakażenia w obrębie ludzkiego gospodarza nawet po etapie krew infekcja została wyczyszczona. Względne długości odstępu między rzutami w niektórych P. vivax izoluje prawdopodobnie opisuje jego zdolność do utrzymywania cykle transmisji w niektórych umiarkowanym klimacie.
Liczne badania epidemiologiczne wykazały, że molekularna P. falciparum może także powodować długoterminowe infekcji przewlekłych (patrz Roper et al poniżej).
Roper, i inni (1996) AJTMH 54: 325
|
|
||||||||||||||||||||||||
W odniesieniu do przyjmującego, ludzie są jedynym znaczącym rezerwuarem pasożyta i trwały transmisji zależy utrzymanie pulę osób zakażonych i kontaktu między ludźmi i komarów anopheline. Kilka czynników wpływa na podatność na zakażenia u ludzi. Oczywiście stan immunologiczny danej osoby i ich wcześniejsze doświadczenia z malarią wpłynie na przebieg infekcji. Kobiety w ciąży, zwłaszcza podczas pierwszej ciąży, są bardziej podatne na malarii tropikalnej, jak pokazano przez częstsze występowanie infekcji i wyższych parazytemii. Dodatkowo, niektóre choroby genetyczne i polimorfizm są związane z zakażeniem lub zmniejszenia choroby (patrz wrodzoną odporność).
Potencjał komara służyć jako wektora zależy od zdolności do podtrzymywania sporogenezy, komary obfitości, a kontakt z ludźmi, które są pod wpływem czynników atmosferycznych i ekologicznych (tabela). Zdolność do wspierania sporogenezy jest w dużej mierze zależna od gatunku, że nie wszystkie gatunki Anopheles są podatne na Plasmodium infekcji. Temperatury i komara długowieczność są inne kluczowe czynniki wpływające na oddziaływanie pasożyta z wektorem. Rozwój P. falciparum wymaga minimalnej temperatury 20°C, przy czym temperatura minimalna dla innych gatunków, to 16°C. Temperatura ma również wpływ na czas rozwoju na tym, że czas trwania sporogenezy zasadniczo krótszy przy wyższej temperaturze.Krótszy czas sporogenezy zwiększa prawdopodobieństwo, że komary będą przenosić zakażenie na jego żywotność.
Czynniki wpływające Vectorial Pojemność |
||||||
|---|---|---|---|---|---|---|
|
Gęstość komara i nawyki żywieniowe również wpływają na transmisję malarii. Gęstość komar ma wpływ temperatura, wysokość, opadów i dostępności miejsc lęgowych, natomiast styk człowiek-komar będzie pod wpływem zachowań komarów.Na przykład, stopień, w jakim konkretny gatunek komarów jest antropofilnych wpłynie prawdopodobieństwo komara uniknąć infekcji, a następnie transmitowanie infekcję innego człowieka.Te antropofilnych tendencje muszą być absolutna w tym wiele zoofilnych komarów przełączy się na ludziach, jeśli gęstość osiągnąć wysokie poziomy lub preferowanym źródłem zwierzę jest ograniczona. Korzystny czas podawania i czy komar zasila przede wszystkim w pomieszczeniach jak i na zewnątrz będą miały wpływ na dynamikę transmisji. Na przykład, outdoor karmienia komary są bardziej prawdopodobne, aby znaleźć ludzi posiłek krwi we wczesnym wieczorem niż te karmienia późno w nocy, kiedy większość ludzi jest w środku. Zachowanie komarów należy również uwzględnić w działaniach kontrolnych.
Odporność
Osoby mieszkające na terenach endemicznych rozwijają odporność na malarię. Prawie zawsze ktoś będzie wykazywać objawy podczas początkowych ekspozycji na malarię.
| „Paradoksalnie, ryzyko ostrej choroby u dzieci są tańsze w populacjach o największej intensywności transmisji, a najwyższe ryzyko choroby były w populacjach narażonych na działanie niskich do umiarkowanych intensywności przekazywania obserwowane”.
Śnieg i inni (1997) Lancet 349: 1650 |
Objawy związane z kolejnymi ekspozycjami na malarię są zazwyczaj łagodniejsze, choć. Odporności przeciwko malarii rozwija się powoli i wymaga wielokrotnej ekspozycji. Na terenach endemicznych tylko bardzo małe dzieci są na wysokie ryzyko rozwoju ciężkiej malarii falciparum, natomiast starsze dzieci i dorośli są zasadniczo chronione przed ciężką chorobą i śmiercią.Jednakże immunitet ten nie jest odporność na sterylizację, że osoby wciąż mogą się zarazić. Ponadto odporność jest krótkotrwały i braku narażenie poziom odporności maleje. Na przykład, dorośli uprzednio semi-immunologiczne często ciężkiej malarii po powrocie do obszaru endemicznego po będąc w obszarze non-endemicznego za 1-2 lata. Ten stan częściowego odporności, w których Parazytemia jest obniżone, ale nie wyeliminowane, a Parazytemia jest lepiej tolerowany (Rysunek) jest czasami określany jako premunition. Premunition odnosi się do odporności, które uzależnione jest od patogen jest obecny.
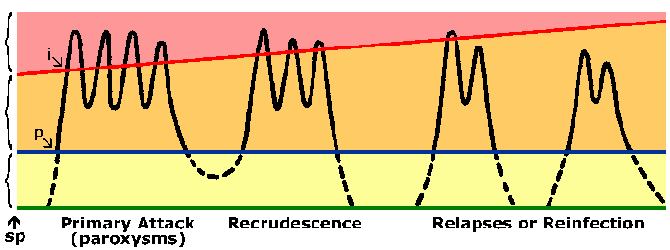
Odpowiedź immunologiczna może być skierowane albo pre-erytrocytowe lub erytrocytowym stadium cyklu życiowego pasożyta. Jednak erytrocytowym etapem cyklu jest prawdopodobnie najważniejszym z punktu widzenia usuwania pasożyta i łagodzenia choroby. Ze względu na brak cząsteczek HLA na powierzchni pasożyta lub erytrocytów jest to zwykle przyjmuje się, że przeciwciało będzie odgrywać kluczową rolę w odporności krwi stadium. Możliwe do mechanizmów efektorowych przeciwciał obejmują: blokowania inwazji erytrocytów przez merozoitów zależnej od przeciwciał zabijanie komórek, w której pośredniczy cytophilic przeciwciał lub zwiększenie klirensu zakażonych erytrocytów, ze względu na wiązanie się przeciwciał do antygenów pasożytniczych eksponowane na powierzchni erytrocytów. Wszystko to spowoduje niższą parazytemią. Względne znaczenie tych różnych mechanizmów nie jest jasne i prawdopodobnie odporność prawdopodobnie wymaga wytwarzanie przeciwciał przeciwko wielu celów. To, wraz z zmienności antygenowej i polimorfizmów w wielu Plasmodium antygeny, może wyjaśniać powolny rozwój odporności.
Obserwacja, że osoby bezobjawowe może wykazywać wysoki poziom parazytemią doprowadziło do pojęcia odporności przeciw chorobie “. Byłoby to oprócz „przeciwpasożytowa” odporności omówionego powyżej, który prowadzi się w niższych parazytemii. Ciężkie malarii i śmierć są powiązane z TNF-a i innych cytokin prozapalnych. Jak omówiono dla paraxoysms i mózgowe malarii , antygeny i toksyny uwalniane przez zakażonych erytrocytów może stymulować produkcję cytokin prozapalnych. Przeciwciała przeciw tym egzo antygenów mogłaby neutralizować ich toksycznych skutków, a tym samym prowadzi do odporności przeciw chorobom.
Przeglądu w sprawie zwalniania Malaria:
J Langhorne, FM Ndungu AM Sponaas, K Marsh (2008) Odporność na malarię: więcej pytań niż odpowiedzi. Nature Immunology 9, 725 – 732 .
Ze względu na trudności w kontrolowaniu malarii za pomocą innych środków jest znacznie zainteresowanie opracowaniem szczepionki przeciwko malarii. Obecnie nie ma dostępnej szczepionki, ale istnieje duże wysiłek badawczy skierowany do identyfikacji kandydatów szczepionek i testowania potencjalnych szczepionek dla bezpieczeństwa i skuteczności. Złożony cykl życia i biologii pasożyta zapewniają kilka potencjalnych celów (Tabela 15.9). Na przykład, szczepionka przeciw sporozoitu albo exoerythrocytic etapie może zapobiec infekcji. Jednak wywoływały odporność musiałby być w pełni skuteczna, ponieważ wyjście z jednego sporozoitu może prowadzić do zakażenia krwi i stopnia choroby. Szczepionki skierowane przeciwko merozoitów lub zakażonych erytrocytów obniżyłoby parazytemii poprzez zakłócanie inwazji merozoity lub zwiększając eliminację zakażonych erytrocytów. Taka szczepionka mogłaby potencjalnie złagodzić wiele z patogenezą związanej z malarią, nawet jeśli nie zostały zakończyć skuteczne. Ponadto, zakażenie może służyć do wzmocnienia odpowiedzi immunologicznej. Może to być możliwe do szczepienia przeciw chorobie przez immunizację przeciwko potencjalnie toksyczne antygeny. Przeciwciał neutralizujących antygeny, które stymulują wydzielanie prozapalnego odpowiedzi immunologicznej może zmniejszyć niektóre patogenezie związanej z malarią. Etapy seksualne pasożytem takim jak gametocytes i gametach może być również ukierunkowane.Przeciwciała skierowane przeciwko antygenom gamet może zapobiegać zakażeniu i sporogenezy komara. Taka szczepionka byłaby w altruistyczne, że nie chroni jednostki przed chorobą, ale chronić innych we wspólnocie poprzez obniżenie transmisję.
| Potencjał Vaccine Strategie | ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
Genetyka człowieka i Odporność wrodzona
| Odporność wrodzona |
|---|
|
Niektóre choroby genetyczne i polimorfizm są związane z zakażeniem lub zmniejszenia choroby (ramka). Na przykład, osoby, którym brak antygenu grupy krwi Duffy są oporne na P. vivax . Duża część populacji w zachodniej Afryce Duffy ujemny, co stanowiło niskich poziomach P. vivax w zachodniej Afryce.Ta wrodzona odporność doprowadziły do identyfikacji antygenu Duffy jako receptor dla erytrocytów inwazji merozoity. (Patrz interakcji receptor-ligand podczas inwazji merozoity).
Kilka dziedziczne zaburzenia erytrocytów występują głównie w obszarach endemicznych malarii i przy częstotliwościach znacznie wyższe niż oczekiwano. Doprowadziło to do spekulacji, że zaburzenia te nadają pewną ochronę przed malarią. Na przykład, Azji Południowo-Wschodniej ovalcytosis jest spowodowana mutacją w białku błony erytrocytów zwanym zespołem 3. Mutacja ta powoduje błony erytrocytów, by stać się bardziej sztywny i bardziej oporne na merozoitów inwazję.Mechanizm (y), w której inne choroby może nadawać ochronę przeciwko malarii, nie są znane. W większości przypadków, to zakłada się, lub Przypuszcza się, że kombinacja wady i zakażenie prowadzi do przedwczesnego rozpadu lub klirensu zainfekowanego erytrocytów. Na przykład, dehydrogenaza glukozo-6-fosforanu (G6PD) pozbawionej erytrocytów miałoby upośledzoną zdolność do radzenia sobie ze stresem oksydacyjnym (patrz Drug Action ). Dodatkowych utleniaczy w wyniku metabolizmu pasożytniczej trawienia hemoglobiny (patrz Biochemistry Uwagi ) może przerastają zainfekowanego erytrocytów i doprowadzić do jego zniszczenia przed pasożyt jest w stanie zakończyć schizogony. Anemia sierpowata i talasemia są Spekulowano również, aby zakażonych erytrocytów bardziej podatne na stres oksydacyjny.
Opinie na temat polimorfizmów czerwonych krwinek i malarii:
- G Min-oo P Gros (2005) wariantów erytrocytów i charakter ich malarii efekt ochronny. Komórkowej Microbiology 7, 753-763 .
- TN Williams (2006) Human czerwonych krwinek polimorfizmy i malaria. Current Opinion in Microbiology 9, 388-394 .
- TN Williams (2006) uszkodzenia krwinek czerwonych i malaria. Molecular and Biochemical Parasitology 149, 121-127 .
Malaria w Stany Zjednoczone
Malaria była wcześniej bardziej powszechne w obszarach umiarkowanych tym w Ameryce Północnej i Europie. Uważa się, że malarii wprowadzano do Ameryki przez osadników europejskich ( P. vivax i P. malariae ) i afrykańskich podrzędnych ( P. falciparum) W ciągu 16 i 17 wieku. Malaria stał endemiczny w wielu częściach Stanów Zjednoczonych z wyjątkiem pustyń i obszarów górskich i częstości prawdopodobnie osiągnęły wartość około 1875. Przesunięcie ludności z obszarów wiejskich do miast, odwadniania bagien utworzyć pole, ulepszoną obudowę i odżywiania, lepsze warunki społeczno-ekonomiczne i standardów dzienny, większy dostęp do usług medycznych, a także dostępność do leczenia chininy przyczyniły się do spadku częstości występowania malarii nawet przed wprowadzeniem szczególnych środków kontroli (karton).Niektóre czynności kontrolne, takie jak wykrywanie choroby i leczenia, zwalczania larw i domu oprysków, zostały wprowadzone w ciągu 1940 roku i doprowadziła do zwalczania malarii w Stanach Zjednoczonych. Od 1950 roku prawie wszystkie przypadki malarii w USA zostały przywiezione.
| Czynniki prowadzące do spadku transmisji malarii w USA |
|---|
|
Zdecydowana większość przypadków malarii zdiagnozowanych w Stanach Zjednoczonych są nabywane przez osoby podczas podróży do krajów, gdzie malaria jest chorobą endemiczną.Jednak w trakcie 1990 roku było kilka ognisk autochtonicznej transmisji malarii w USA ( Zucker, 1996 ). Ogniska te wiązały się z gęsto zaludnionych i dużej liczby imigrantów. Więcej niż 80% przypadków są P. vivax . Ponadto, ogniska te związane z niezwykle gorące i dużej wilgotności powietrza, co może zwiększyć przeżywalność i anopheline zmniejszyć czas trwania cyklu sporogonic, umożliwiając w ten sposób rozwojowi zakaźnych sporozoitami. (Patrz również ostatni raport na siedem przypadków lokalnie nabyte P. vivax malarii, które miało miejsce na Florydzie w lipcu-sierpniu 2003 roku, MMWR 52: 908).
zmniejszenia kontaktu człowieka komara
zmniejszenia gęstości wektor
zmniejsza pasożytniczą zbiornik
|
Zapobiegania i Kontroli
Strategie zapobiegania i zwalczania malarii obejmować trzy różne podejścia (patrz ramka). Zapobieganie malarii u osób ogólnie będzie obejmować redukcję kontaktu człowieka komarów poprzez wykorzystanie moskitier, repelenty, itd profilaktyki farmakologicznej ( patrz poniżej ), mogą być również wykorzystywane, zwłaszcza w podróżnych. Jednak profilaktyki farmakologicznej tylko tłumi parazytemii i nie zapobiega zakażeniu.
Działania kontrolne na szczeblu wspólnotowym mogą wykorzystywać podejścia, które bezpośrednio zmniejszenia kontaktu człowieka z komara, jak podejść, które zmniejszają całkowitą liczbę komarów na danym obszarze. Takie metody obejmują redukcję lęgowych moskitów (np modyfikacji ochrony środowiska) docelowego etapy larwy chemicznymi lub biologicznymi i masową owadobójczy do rozpylania na komary dorosłych. Biologiczne metody sterowania obejmują wprowadzenie ryb jedzenia larwy komara lub bakterii (na przykład Bacillus thuringiensis), Które wydzielają larwalne toksyny. wykrywanie i leczenie przypadek jest inny potencjalny sposób sterowania. Rozpoznawanie i leczenie zainfekowanych osób, zwłaszcza osoby bezobjawowe, zmniejszy wielkość zbiornika pasożyta w populacji ludzkiej i może obniżyć stawki przesyłowe. Jednak może to być stosunkowo kosztowne podejście.
Metody te nie wykluczają się wzajemnie i mogą być łączone.Wiele udanych programów kontroli obejmują zarówno środki kontroli komarów i leczenia osób zakażonych. Nie ma standardowej metody kontroli malarii, który okazał uniwersalnie skuteczne. W epidemiologicznych, społeczno-gospodarcze, kulturalne i infrastrukturalne czynniki danego regionu określi najbardziej odpowiedniej kontroli malarii. Niektóre czynniki, które należy rozważyć, obejmują:
- infrastruktury istniejących usług opieki zdrowotnej i innych zasobów
- intensywności i częstotliwości (np sezonowość) przesłania
- gatunków komarów (wymagania ekologiczne, charakterystyki zachowania, owadobójczy czułość, etc.)
- gatunki pasożytów i czułość leku
- cechy kulturowe i społeczne ludności
- Obecność zmian społecznych i ekologicznych
Kontroli malarii w Afryce tropikalnej jest szczególnie problematyczne ze względu na wysokie prędkości transmisji i ogólnego poziomu społeczno-gospodarczego niskie. Liczne badania wykazały, że traktowane środkiem owadobójczym antymalarycznych (ITBN) zmniejszenie zachorowalności i śmiertelności związanych z malarią. W większości obszarów wprowadzenie moskitier nie wymagają dużych programów promocyjnych, a ich stosowanie jest łatwo akceptowane. Może to być po części ze względu na zmniejszenie uciążliwości komarów gryzienia. Niektóre kwestie zostały podniesione w odniesieniu do zrównoważonego rozwoju gospodarczego programów bednet. Konieczne jest ponowne traktować moskitier środkiem owadobójczym okresowo i moskitier muszą być naprawiane i wymieniane, ponieważ stają się rozdarty i zużywają się. Ponadto, niektóre wzbudziły obawy co do długoterminowych korzyści płynących z moskitier, ponieważ zmniejszają ekspozycję, ale nie wyeliminować.
[Recenzja na kontroli malarii: RS Phillips (2001) Aktualny stan malarii i możliwości kontroli. Clin. Microbiol. Obj 14: 208].
Diagnoza
|
Malaria podejrzewa u osób z wywiadem jest na obszarze endemicznym i prezentuje objawy zgodne z malarią (patrz objawy kliniczne ). Objawy te, szczególnie we wczesnych etapach infekcji, są niespecyficzne i często opisywany jako grypopodobnych. Wraz z postępem choroby, pacjent może wykazywać powiększenie śledziony i / lub wątroby i niedokrwistości. Diagnoza zostanie potwierdzona za pomocą mikroskopu. Grube rozmazy krwi są na ogół bardziej wrażliwe na wykrycie pasożytów, a cienkie smugi są korzystne do identyfikacji gatunków. (Patrz krwi etap morfologię z Plasmodium gatunków). Jeśli osobnicy nie znajdują się na pierwszym rozmaz krwi, to zaleca się, aby wprowadzić dodatkowe wymazów co 6-12 godzin, przez okres do 48 godzin.Wstępne rozpoznanie P. falciparum (liczne i wyłącznie pierścień etapy) może stanowić nagły, zwłaszcza u osób nie odpornościowego. Testy szybki immunochromato (tj przymiary) oparte na wykrywaniu antygenu są również dostępne (patrz opinia).
 |
 |
 |
 |
Chemioterapia and Odporność na Leki
Kilka leki przeciwmalaryczne są dostępne. Wiele czynników biorą udział w podejmowaniu decyzji o najlepsze leczenie malarii.Czynniki te obejmują gatunki pasożytów, ciężkość choroby (np. Skomplikowanych), wiek pacjenta, stan odpornościowy, podatność pasożyta na leki (np lekooporności), koszt i dostępność leków. Dlatego dokładne zalecenia często będą się różnić w zależności od regionu geograficznego. Ponadto, wiele leków działa w różny sposób w różnych etapach cyklu życia (tabela). Inne interesujące linki:
- Mechanizmy działania i Odporność na leki
- Wirtualny Naval Hospital, informacje na temat leczenia i leki przeciwmalaryczne
- WHO, poradnik anty-malalarial użytkowania
- Medyczne List artykuł na Leki stosowane infekcje pasożytnicze
| Wybrane leki przeciwmalaryczne | ||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
Szybko działający schizontocides krwi, które działają po etapie krew pasożytów, można stosować do leczenia ostrych infekcji i szybko łagodzi objawy kliniczne. Chlorochina jest zwykle zalecane w leczeniu pacjentów z P. vivax, P. ovale, P. malariae i nieskomplikowanych chlorchininy wrażliwe falciparum P. infekcji. Chlorochina jest bezpieczne i zazwyczaj dobrze tolerowane. Efekty uboczne mogą obejmować świąd (IE, swędzenie), nudności lub pobudzenie. Pacjenci zakażeni albo P. vivax i P. ovale Oraz, że nie są w stanie wysokiego ryzyka ponownego zakażenia, powinny być również traktowane prymachiny (a schizontocide tkanki). Prymachina jest skuteczny przeciwko etapie wątroby pasożyta, w tym Hipnozoity (patrz nawrotów) i zapobiega przyszłe nawroty choroby. Połączenie chlorochina i prymachina jest często nazywany „radykalne lekarstwo”.
Ciężkie lub skomplikowane, falciparum malaria jest poważną chorobą, z wysoką śmiertelnością i muszą być traktowane jako zagrażające życiu, a tym samym wymaga pilnego leczenia.Leczenie wymaga zazwyczaj pozajelitowe podawanie leku (tj zastrzyki), ponieważ pacjenci są często w stanie śpiączki lub wymioty, a zatem nie może przyjmować leków doustnie.Preparaty do podawania pozajelitowego są dostępne na chlorochinę, chinina, chinidyna i artemizyniny pochodne.Pochodne Artemizyna są zwykle preferowanym wyborem, ale nie są jeszcze zatwierdzone wszędzie. Na przykład, w Stanach Zjednoczonych i chininy chinidyny są zatwierdzone leki przeciw malarii złośliwej. Pacjenci muszą być stale monitorowane pod kątem hematokrytu, parazytemią, poziom nawodnienia, hipoglikemii i objawy toksyczności leków i innych powikłań w trakcie leczenia. Służy do podawania doustnego powinny być jak tylko pacjent jest w stanie. Większość zgonów z powodu ciężkiej malarii występuje w lub w pobliżu domu, w sytuacjach, w których pacjenci nie mogą być brane do szpitala. czopki Artemizyna które mogą być podawane przez pracowników służby zdrowia wsi zostały również opracowane i okazały się bezpieczne i skuteczne.
Skuteczność chlorochina jest znacznie zmniejszone przez szeroki spread chlorochinowym odporność na P. falciparum i pojawienie chlorochinowym odporne P. vivax. Jeśli leczenie chlorochina nie jest efektywne, lub w obszarze o chlorchininy odporne malarii typowe sposoby leczenia obejmują: meflochinę, chininę w połączeniu z doksycykliną lub Fansidar®. Pochodne artemizyny (dihydroartemizyninę, artesunian i artemeteru) są coraz częściej wykorzystywane w Azji i Afryce, a obecnie zalecane jako pierwszej linii leczenia przez Światową Organizację Zdrowia. Leki te były pierwotnie pochodzące z roślin piołunu (Artemesia annua) I zostały wykorzystane przez długi czas w Chinach jako herbata ziołowa zwana quinhaosu w leczeniu chorób gorączkowych. Aby uniknąć wysokich wskaźników wzrostu liczby związane z pochodnymi artemizyniny oraz zahamowania rozwoju oporności na lek, zaleca się, aby leczenie w połączeniu z niezwiązanym przeciw malarii. Leki stosowane w połączeniu z artemizyniny obejmują meflochinę, lumefantryna, Fansidar® i Amodiachina.
Profilaktyki farmakologicznej. Profilaktyki farmakologicznej jest szczególnie ważne dla osób z nie-malaryczny obszarów, które odwiedzają terenach endemicznych malarii. Takie osoby nie-immunologiczne mogą szybko rozwijać poważne i zagrażające życiu choroby. Podobnie jak w przypadku leczenia nie ma standardowego rekomendacja i wybory do profilaktyki farmakologicznej są silnie uzależnione od warunków związanych z podróżą i indivdual osoby. (Patrz CDC zestawieniu dotyczącym zapobiegania malarii). Chemioprofilaktyki wymaga stosowania nie-toksycznych leków, ponieważ te leki będą brane przez dłuższy okres czasu. Generalnie pacjent zacznie się przyjmowanie leku przed podróżą, a następnie kontynuować przyjmowanie leku w trakcie pobytu na terenie endemicznym i kontynuować przyjmowanie leku po powrocie. Ma to na celu zapewnić lek jest utrzymywana na wystarczającym poziomie całej wizyty i na zewnątrz w celu ochrony przed zakażeniem uzyskanych podczas każdej wizyty. Niestety, wiele skutecznych, nietoksycznych leków (na przykład, chlorochina, pirymetamina, proquanil) są ograniczone zastosowanie z powodu oporności na lek. Inną strategią jest przypuszczalny (lub „standby”) leczenie należy stosować w połączeniu z profilaktyki. W tym przypadku, gdy osoba albo rezygnuje profilaktyki lub wykonuje chlorochinę lub innego stosunkowo mało toksyczne leku do profilaktyki i zawiera lek, takie jak fansidar,
Zastosowanie meflochina dla malarii profilaktyki farmakologicznej jest nieco kontrowersyjna. Mefloquine jest skuteczny w zapobieganiu malarii z pojedynczym robi tygodniowo, oferując tym samym korzyści dla leków, które muszą być podawane codziennie. Przy tej dawce mefloąuinę jest tolerowany przez większość osób. Jednak niektórzy ludzie doświadczają neuropsychiatryczne niekorzystny wpływ takich jak zaburzenia snu i koszmary. To może być pogarsza podróży międzynarodowej, która jest stresujące wydarzenie.Randomizowane, kontrolowane badania oślepiony i wskazują, że niekorzystny wpływ neuropsychiatryczne są tylko nieznacznie wyższe niż z meflochina z innymi przeciwmalaryczne.
Zabicie exoerythrocytic etapu (tzn wątroby) uniemożliwiają zakażenia krwi i znany jest jako przyczynowy profilaktyki. Jest wysoce pożądane, że ogranicza ilość czasu profilaktycznego lek należy podjąć przed i po podróży na obszarze endemicznym.Jedynym lekiem obecnie dostępny dla profilaktyki przyczynowej jest primachinę. Jednak malaria profilaktyka nie jest zatwierdzony wykorzystanie prymachina i powinien być przepisywany tylko w profilaktyce na podstawie indywidualnego przypadku. Na przykład, dla osób, które często mają wyjazdy krótkotrwałe do obszarów endemicznych i bardzo, że dana osoba nie wykazuje niedobór dehydrogenazy glukozo-6-fosforanowej.Tafenoquine przechodzi obecnie ocenę polową na jej stosowanie w profilaktyce przyczynowych.
Opinie na temat leczenia malarii:
- Pasvol G (2006) Leczenie skomplikowaną i ciężką malarię. Br Med Bull 75-76: 29-47 .
- Newton P and White NJ (1999) Malaria: Nowe osiągnięcia w leczeniu i profilaktyce. Annu Rev Med 50: 179.
- Biały NJ (1996), w leczeniu malarii. N Engl J Med 335: 800.
- Biały NJ (2008) Qinghaosu (Artemizyna): cena sukcesu. Science 320, 330-334 .
Odporność na leki
Oporność na leki, w szczególności odporność chlorochina jest poważnym problemem zdrowia publicznego w zwalczaniu malarii. Oporność na leki jest określony przez niepowodzenie leczenia i mogą być klasyfikowane na różnych poziomach, w zależności od czasu wzrostu liczby po leczeniu (fig). Tradycyjnie te poziomy oporności określono jako wrażliwe (brak wzrostu liczby) RI (opóźnienie nawrót), FcyRII (wczesny nawrót) i FcyRIII (minimalne lub żadne działanie przeciw pasożytom).Zmodyfikowany protokołu na podstawie wyników klinicznych wprowadzono przez WHO w 1996. W tym protokole poziom oporności jest wyrażona jako odpowiednią odpowiedzią kliniczną (ACR), późne niepowodzenia leczenia (LTF), albo na początku niepowodzenia leczenia (EFS), jak określono w następujących:
- ACR brak parazytemii (niezależnie od gorączki) lub bez objawów klinicznych (niezależnie parazytemii) 14 dnia obserwacji
- LTF, nawrót objawów lub obecność parazytemii w ciągu 4-14 dni obserwacji
- EFK utrzymywanie się objawów klinicznych w obecności parazytemii w ciągu pierwszych 3 dni obserwacji
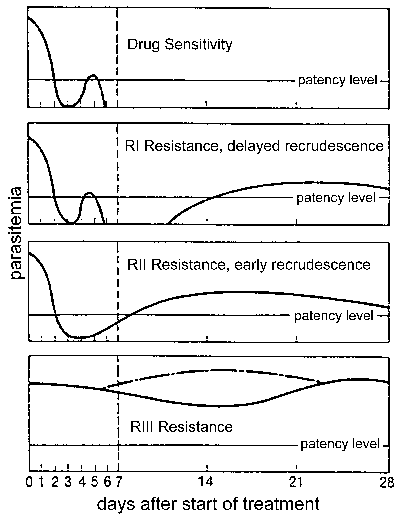
Albo protokół może być wykorzystane do określenia oporności na leki, lecz protokół kliniczny wynik jest bardziej praktyczny w obszarach intensywnej transmisji, gdzie może być trudna do odróżnienia ponownej infekcji wzrostu liczby i gdzie Parazytemia przy braku objawów klinicznych jest powszechne. Lekooporności albo protokół określa się za pomocą testów in vivo, w których pacjenci są hospitalizowani i monitorowane podczas i po standardowej terapii leków. W badaniach in vitro, które można ocenić poziom lekooporności przez określenie skuteczności leków przeciw są również P. falciparum w hodowli (patrz lekooporność Malaria przy WHO). Testy in vitro i in vivo, nie zawsze odpowiadają ponieważ odporność gospodarza i innych czynników może wpłynąć na wyniki badań in vivo.Zidentyfikowanie specyficznych mutacji, które mogą być związane z opornością na lek (patrz tabela na drugiej stronie), może prowadzić do rozwoju badań opartych o markery molekularne.
Oporność na leki pasożytów rozwija się, gdy z obniżoną wrażliwość na leki przeciwmalaryczne są wybrane pod ciśnieniem leku. Zmniejszona wrażliwość na lek może być nadawana przez kilka mechanizmów (patrz Mechanizmy lekooporności) I odzwierciedla mutację genetyczną (ów) lub polimorfizmu w populacji pasożyta. Pasożyty lek opór mają zaletę w stosunku do pasożytów, wrażliwe na leki w obecności leku i będzie preferencyjnie transmisji. Głównymi czynnikami w rozwoju oporności na lek jest stosowanie subterapeutycznych dawkach leków lub którzy nie ukończyli schematu leczenia (tabela). Niższe poziomy leków wyeliminuje najbardziej podatne pasożyty, ale te, które tolerują leku odzyska i rozmnażać. W czasie prowadzi to do dalszej selekcji pasożytów, która może wytrzymywać nawet wyższe dawki leku. Istotne jest utrzymanie odpowiedniego stężenia leku przez czas wystarczający do całkowitego wyeliminowania pasożytów z danej jednostki.
| Czynników przyczyniających się do rozwoju i rozprzestrzeniania się lekooporności |
||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
Podstawą jest zmniejszona odporność chlorochinowym Chloroquine kumulacja w wakuoli pasożyta żywności. Ponadto, odporność na chlorochinę można częściowo odwrócić inhibitory p-glikoproteiny (transporter ABC), które są odpowiedzialne za oporność na wiele leków (MDR), w liniach komórek nowotworowych, co sugeruje podobne zjawisko może występować w Plasmodium. Mutacje w MDR-like genu z P. falciparum (Pf MDR1) były związane z opornością na chlorochinę. Jednakże, mutacje te nie nadają się do prognozowania oporu chlorochinowym we wszystkich obszarach geograficznych. Pf MDR1 wydaje się przyczyniać do stopnia odporności chlorochinowym, ale sam jest niewystarczająca, aby oporność. Jednak PfMDR1 wydaje się odgrywać rolę w odporności na meflochina i halofantryną i wpływa na wrażliwość na artemisininu.
Innym kandydatem do locus oporności na chlorochinę zidentyfikowano za pomocą krzyża genetycznej i eksperyment odwzorowania. Region 400 kb chromosomu 7 Stwierdzono segregację z opornego na chlorochinę i dalszej analizy sugerują, że pojedynczy gen, zwany Pf CRT, był odpowiedzialny za odporność wobec chlorochiny. Spośród łącznie 10 polimorfizmów identyfikowanych w tym genie, tylko pojedyncza mutacja jest perfectedly związane z fenotypem oporności chlorochina. Mutacja ta prowadzi do lizyny w reszcie 76 ulega zmianie na treoninę (K76T). Liczne badania polowe wykazały powiązanie pomiędzy Pf kineskopowego K76T i chlorchiny oporowych, zarówno in vivo jak i in vitro w metodach. Został on niedawno zasugerował, że było co najmniej 4 mutacje założycielskie w Pfcrt gen związany z różnych regionów geograficznych: Azja/Afryka, Papua Nowa Gwinea, Brazylia/Peru i Kolumbii (Wootton et al, Nature 418: 320, 2002). Przypuszczalnie stosowanie chlorchiną w wyniku późniejszej selekcji i rozprzestrzeniania się z fenotypem opornościowym.
Opinie na temat lekooporności:
- Boland PB (2001) Odporność na leki na malarię. WHO / CDS / CSR / DRS / 2001.4
- Hyde malarii JE (2007), oporne na leki – wgląd. FEBS Journal 274, 4688-4698.
- Warhust D (2001) Nowe rozwiązania: chlorochina odporność w Plasmodium falciparum. Odporność na leki Updates 4: 141.
- Wellems TE i plowe CV (2001) Chlorochin odporne na malarię. J. Inf Dis 184: 770.
- Wongsrichanalai C Pickard Al, Wernsdorfer WH oraz Meshnick Sr (2002) Epidemiology of lekoopornej malarii. Lancet Infect Dis 2: 209.